تازههای پزشکی قلب و عروق: بخش اول
آریتمیها
- مهار فاکتور XI فعال شده برای بیماران مبتلا به فیبریلاسیون دهلیزی (سپتامبر ۲۰۲۴ NEJM)
بیماران مبتلا به فیبریلاسیون دهلیزی (AF) برای جلوگیری از عوارض ترومبوآمبولیک نیاز به ضدانعقاد دارند، اما درمان استاندارد با ضدانعقاد خوراکی مستقیم (DOAC) عوارض خونریزی ایجاد میکند. مهار فاکتور XI فعال شده (XIa) به عنوان یک هدف ضدانعقادی برای کاهش خطر ترومبوآمبولیک با خونریزی بالقوه کمتر نسبت به DOACها پیشنهاد شده است. در یک کارآزمایی بینالمللی که در آن تقریباً ۱۵۰۰۰ بیمار مبتلا به AF به طور تصادفی به آسوندکسیان (یک مهارکننده فاکتور XIa) ۵۰ میلیگرم روزانه یا دوز استاندارد آپیکسابان (یک DOAC) اختصاص داده شدند، کارآزمایی به دلیل بروز بالاتر سکته مغزی یا آمبولی سیستمیک با آسوندکسیان در مقایسه با آپیکسابان زودتر متوقف شد؛ خونریزی شدید با آسوندکسیان کمتر بود.
نتیجهگیری: مطالعات با سایر عوامل در حال انجام است تا مشخص شود آیا میتوان به میزانی از مهار فاکتور XIa دست یافت که محافظت مؤثری در برابر ترومبوآمبولیسم با خطر خونریزی کمتر نسبت به DOAC فراهم کند. - انتخاب ضدانعقاد برای بیماران مبتلا به فیبریلاسیون دهلیزی و بیماری مزمن کلیوی شدید (سپتامبر ۲۰۲۴ JAHA)
بیماران مبتلا به فیبریلاسیون دهلیزی (AF) و بیماری مزمن کلیوی شدید (CKD) با خطرات افزایشیافته خونریزی و ترومبوآمبولیسم مواجه هستند؛ ضدانعقاد بهینه در این شرایط نامشخص است. در یک مطالعه مبتنی بر پایگاه داده بالینی که تقریباً ۷۰۰۰ بزرگسال غیروابسته به دیالیز مبتلا به AF و CKD شدید را شامل میشد، آپیکسابان استفاده با خطر کمتر خونریزی شدید همراه بود نسبت به ریواروکسابان یا وارفارین استفاده، در حالی که نرخ سکته مغزی/آمبولی سیستمیک و مرگ در بین سه ضدانعقاد مشابه بود.
نتیجهگیری: این مطالعه و سایر دادههای مشاهدهای از استفاده از آپیکسابان به عنوان ضدانعقاد ترجیحی برای بیماران مبتلا به AF و CKD شدید حمایت میکنند. - سیستم پیسمیکر-دفیبریلاتور بدون لید برای درمان تاکیکاردی بطنی (ژوئیه ۲۰۲۴ NEJM)
دفیبریلاتورهای کاردیوورتر قابل کاشت زیر جلدی (S-ICD) برای فراهم کردن پیسینگ برای برادیکاردی یا تاکیکاردی بطنی (VT) طراحی نشدهاند، اما یک سیستم پیسینگ بدون لید میتواند به صورت نظری پیسینگ ضد تاکیکاردی (ATP) را برای VT حس شده توسط S-ICD فراهم کند. در یک مطالعه اخیر بر روی بیش از ۱۶۰ بیمار در معرض خطر VT که اندیکاسیون برای قرار دادن S-ICD داشتند، بیماران تحت قرار دادن یک پیسمیکر بدون لید با قابلیت ارتباط بیسیم با S-ICD خود قرار گرفتند. پس از کاشت، VT با موفقیت با ATP از سیستم پیسینگ بدون لید در ۶۱ درصد بیماران خاتمه یافت و تمام اپیزودهای دیگر VT یا با شوک از S-ICD یا به طور خودبهخودی خاتمه پیدا کردند.
نتیجهگیری: در بیماران بسیار منتخب، افزودن یک دستگاه پیسینگ بدون لید با اتصال بیسیم به S-ICD میتواند پیسینگ پشتیبان و پیسینگ ضد تاکیکاردی را فراهم کند. - اثرات بلندمدت درمان بازهمگامسازی قلبی (مارس ۲۰۲۴ NEJM)
در بیماران مبتلا به نارسایی قلبی با کسر جهشی کاهشیافته (HFrEF)، بلوک شاخهای چپ با مدت زمان QRS ≥120 میلیثانیه، و علائم کلاس II تا III انجمن قلب نیویورک، درمان بازهمگامسازی قلبی (CRT) مزایای کوتاهمدت در کاهش مرگومیر دارد، اما دادههای بلندمدت در دسترس نیستند. در یک مطالعه اخیر که پیگیری بلندمدت (میانگین ۷.۷ سال) بیش از ۱۰۰۰ بیمار را که به طور تصادفی به CRT به علاوه یک دفیبریلاتور کاردیوورتر قابل کاشت (ICD) یا فقط ICD اختصاص داده شده بودند، گزارش کرد، نرخ مرگومیر ۱۵ ساله به ترتیب ۷۱ و ۷۶ درصد بود.
نتیجهگیری: در بیماران با اندیکاسیونهای CRT، میزان مرگومیر بالا است، و ما درمان CRT را برای کاهش خطر مرگومیر کوتاهمدت و بلندمدت توصیه میکنیم. - ارتقاء پیسمیکر یا دفیبریلاتور قلبی برای فراهم کردن بازهمگامسازی قلبی (مارس ۲۰۲۴)
در بیماران مبتلا به نارسایی قلبی با کسر جهشی کاهشیافته (HFrEF) که دارای یک دستگاه الکترونیکی قابل کاشت قلبی (CIED؛ یعنی پیسمیکر یا دفیبریلاتور کاردیوورتر داخلی) هستند اما ممکن است از درمان بازهمگامسازی قلبی (CRT) سود ببرند، این نگرانی وجود دارد که خطر ارتقاء دستگاه به یک سیستم با قابلیت CRT ممکن است از مزایای چنین ارتقائی فراتر رود. در یک کارآزمایی اخیر بر روی بیش از ۳۵۰ بیمار مبتلا به HFrEF، با CIED از قبل موجود و اندیکاسیون برای CRT، بیمارانی که به طور تصادفی برای ارتقاء CIED اختصاص داده شدند، خطر کمتری از بستری شدن به دلیل نارسایی قلبی در طول میانگین ۱۲.۴ ماه در مقایسه با کسانی که ارتقاء سیستم را انجام ندادند، داشتند. میزان مرگومیر بین دو گروه مشابه بود.
نتیجهگیری: در بیماران با CIED از قبل موجود که معیارهای CRT را دارند، ما ارتقاء سیستم موجود را توصیه میکنیم.
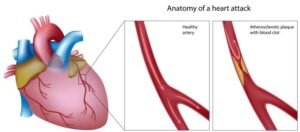
بیماری حاد عروق کرونر
- بتا بلاکرها پس از انفارکتوس حاد میوکارد (ژوئیه ۲۰۲۴ NEJM)
در حالی که مطالعات قدیمیتر نشان میدهند که درمان با بتا بلاکر در بیماران با کسر جهشی طبیعی بطن چپ (LVEF) پس از انفارکتوس حاد میوکارد (MI) مفید است، هنوز مشخص نیست که آیا بتا بلاکرها در بیماران مشابه که با درمانهای مدرن برای MI (مانند مداخله کرونری از راه پوست، تیکاگرلور) درمان شدهاند، مفید هستند یا خیر. در یک کارآزمایی اخیر که بیش از ۵۰۰۰ بیمار با MI حاد و LVEF ≥50 درصد را شامل میشد و به طور تصادفی به درمان با بتا بلاکر یا بدون بتا بلاکر اختصاص داده شدند، نرخ مرگومیر و MI مکرر در هر دو گروه پس از میانگین ۳.۵ سال مشابه بود. - ارزیابی فیزیولوژیک شدت بیماری عروق کرونر (مه ۲۰۲۴ NEJM)
در طول انفارکتوس حاد میوکارد (MI)، شدت بیماری عروق کرونر غیر مقصر معمولاً با آنژیوگرافی تهاجمی کرونر ارزیابی میشود، اما ارزیابی با اندازهگیریهای فشار داخل کرونری ممکن است انتخاب ضایعات کرونری برای بازسازی عروق را بهبود بخشد. در یک کارآزمایی که اخیراً منتشر شد و بیش از ۱۵۰۰ بیمار مبتلا به MI حاد را شامل میشد، بیمارانی که به طور تصادفی به مداخله کرونری از راه پوست (PCI) برای تمام ضایعات غیر مقصر (یعنی بازسازی عروق کامل) با هدایت اندازهگیری ذخیره جریان کسری (FFR) یا به PCI فقط برای ضایعه مقصر اختصاص داده شدند، پس از میانگین تقریباً پنج سال، نرخهای مشابهی از مرگ و MI داشتند. این کارآزمایی پس از شواهدی از کارآزماییهای دیگر که نرخ پایینتری از مرگ و MI را با بازسازی عروق کامل نشان میدادند، زودتر متوقف شد.
نتیجهگیری: در بیماران مبتلا به MI حاد و تنگی عروق کرونر غیر مقصر، ارزیابی آنژیوگرافیک به اندازه کافی دقیق است تا ضایعات هدف برای بازسازی عروق را شناسایی کند؛ ارزیابی FFR به طور روتین مورد نیاز نیست.
بیماری پایدار عروق کرونر
- درمان با آسپرین در بیماران مبتلا به بیماری قلبی عروقی که از ضدانعقاد استفاده میکنند (سپتامبر ۲۰۲۴ NEJM)
آسپرین خطر حوادث ایسکمیک قلبی عروقی را در بیماران مبتلا به بیماری پایدار آترواسکلروتیک قلبی عروقی (ASCVD) کاهش میدهد؛ با این حال، نسبت خطر-فایده برای درمان با آسپرین ممکن است در بیماران مبتلا به ASCVD که برای یک بیماری همزمان ضدانعقاد دریافت میکنند، مطلوب نباشد. این موضوع توسط یک کارآزمایی بر روی بیش از ۱۰۰۰ بیمار مبتلا به فیبریلاسیون دهلیزی و بیماری پایدار عروق کرونر که به طور تصادفی به ضدانعقاد خوراکی مستقیم ادوکسابان به عنوان مونوتراپی یا درمان دوگانه ضد ترومبوتیک (ادوکسابان به علاوه یک عامل ضد پلاکت) اختصاص داده شدند، تأیید شد. در ۱۲ ماه، بروز خونریزی شدید در گروه مونوتراپی ادوکسابان در مقایسه با گروه درمان دوگانه ضد ترومبوتیک کمتر بود، در حالی که بروز حوادث ایسکمیک شدید در دو گروه مشابه بود.
نتیجهگیری: برای بیماران مبتلا به ASCVD پایدار که نیاز به ضدانعقاد برای یک بیماری همزمان دارند، ما به طور روتین آسپرین اضافه نمیکنیم. - مدیریت بیماری عروق کرونر در بیماران تحت عمل کاشت دریچه آئورت از راه کاتتر (سپتامبر ۲۰۲۴ NEJM)
بیمارانی که برای تنگی آئورت تحت عمل کاشت دریچه آئورت از راه کاتتر (TAVI) قرار میگیرند، معمولاً بیماری مزمن عروق کرونر (CAD) دارند. نقش مداخله کرونری از راه پوست (PCI) در این شرایط بالینی در یک کارآزمایی ارزیابی شد که در آن بیش از ۴۵۰ بیمار با CAD مزمن که تحت TAVI قرار میگرفتند، به طور تصادفی به PCI (در بیشتر موارد قبل از TAVI) یا مدیریت محافظهکارانه CAD اختصاص داده شدند. بیمارانی که تحت PCI قرار گرفتند و متعاقباً با درمان دوگانه ضد پلاکت درمان شدند، خطرات دو ساله کمتری از انفارکتوس میوکارد و بازسازی اورژانسی عروق کرونر در مقایسه با کسانی که مدیریت محافظهکارانه دریافت کردند، داشتند.
نتیجهگیری: این یافتهها اهمیت ارزیابی و مدیریت CAD در بیماران تحت TAVI را نشان میدهد. - دستگاه کاهش سینوس کرونری برای درمان آنژین (ژوئیه ۲۰۲۴ LANCET ORBITA-COSMIC)
در بیماران مبتلا به آنژین مقاوم به درمان دارویی و بازسازی عروق، یکی از گزینههای درمانی، قرار دادن دستگاه کاهش سینوس کرونری است که دستگاهی برای بهبود پرفیوژن میوکارد با محدود کردن جریان خون سینوس کرونری است. در یک کارآزمایی اخیر که بیش از ۶۰ بیمار مبتلا به آنژین مقاوم را شامل میشد، بیمارانی که به طور تصادفی برای دریافت دستگاه کاهش سینوس کرونری اختصاص داده شدند، احتمال بیشتری برای بهبود علائم آنژین داشتند تا بیمارانی که به یک روش ساختگی اختصاص داده شدند. با این حال، اثربخشی کلی دستگاه نامشخص بود؛ سایر شاخصهای مهم اثربخشی (مانند میوکارد ایسکمیک در تصویربرداری، زمان ورزش، کلاس آنژین، تعداد عوامل ضد آنژین) بین گروهها مشابه بود.
نتیجهگیری: در بیماران مبتلا به آنژین مقاوم، درمان معمولاً شامل درمان دارویی و بازسازی عروق در صورت لزوم است؛ نقش درمانهای مبتنی بر دستگاه نامشخص باقی میماند.